Biogene Amine - wichtige Botenstoffe im Nervensystem
Äußere Reize können in Zellen transiente Änderungen in der Konzentration „sekundärer Botenstoffe“ auslösen. Wir untersuchen solche Membranproteine, die für die Reizerkennung zuständig sind und die Information an intrazelluläre Signalproteine weitergeben.
Die Kommunikation zwischen Neuronen und ihren Zielzellen beruht auf einer elektrochemischen Signalwandlung an spezialisierten Kontaktstellen der Zellen, den Synapsen. Aktionspotentiale lösen die Freisetzung chemischer Botenstoffe aus dem erregten Neuron aus (Abbildung 1). Botenstoffe können u. a. aus Aminosäuren synthetisiert werden oder auch Peptide sein. Sie wirken als Neurotransmitter, Neuromodulatoren oder Neurohormone. Die freigesetzten Botenstoffe aktivieren spezifische Membranrezeptoren in der Zielzelle und lösen dadurch elektrische oder biochemische Antworten in der Zelle aus.
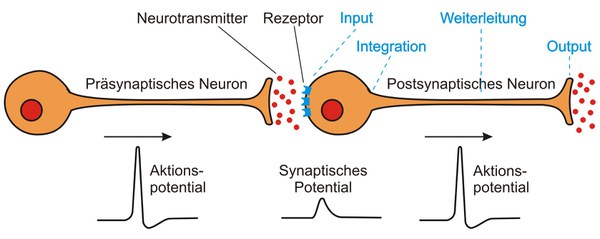
Wenngleich die molekularen Strukturen der Botenstoffe sehr unterschiedlich sind, lassen sich die Rezeptoren, an die sie binden, in zwei große Gruppen einteilen. Man bezeichnet sie als ionotrope und als metabotrope Rezeptoren. Die Bindung eines Botenstoffs an einen ionotropen Rezeptor (= Ligand gesteuerter Ionenkanal) bewirkt die Öffnung der Kanalpore und nachfolgend entweder eine schnelle elektrische Erregung oder Inhibition der Zielzelle. Im Gegensatz dazu führt die Bindung eines Botenstoffs an einen metabotropen Rezeptor (G-Protein gekoppelter Rezeptor; GPCR) zu langsameren Zellantworten. Aktivierte GPCR übertragen das Signal auf intrazelluläre, trimere GTP-bindende (G)-Proteine, die ihrerseits spezifische Effektorproteine stimulieren oder inhibieren können. Dies führt zu Konzentrationsänderungen sogenannter „sekundärer Botenstoffe“ (siehe auch: Guanylyl- und Adenylylzyklasen), z.B. zyklische Nukleotide (cAMP, cGMP), Inositol 1,4,5-trisphosphat (IP3), Diacylglycerol (DAG) und Calcium (Ca2+). Einige Enzyme, die von diesen sekundären Botenstoffen reguliert werden, können wiederum die funktionellen Eigenschaften von verschiedenen Proteinen verändern.
Eine wichtige Gruppe von Botenstoffen, die hauptsächlich an GPCR binden, sind die biogenen Amine (Tabelle 1). Sie entstehen in ein- bis mehrstufigen Syntheseschritten aus einzelnen Aminosäuren. Im Zentralen Nervensystem (CNS) kontrollieren und modulieren biogene Amine z.B. die Cardiovaskuläre Homeostase, Zirkadiane Rhythmen, Emotionen, die endokrine Sekretion, das Sexualverhalten, die Thermoregulation sowie Lernen und Gedächtnisbildung. Beim Menschen sind einige neurale Krankheiten eng mit Fehlfunktionen biogener Amin-abhängiger Signalverarbeitung verknüpft. Deshalb werden große Anstrengungen unternommen, um die molekularen und funktionellen Eigenschaften biogener Amin-Rezeptoren und ihrer nachgeschalteten Interaktionspartner aufzuklären. Die detaillierte Kenntnis dieser Zielstrukturen ist die Voraussetzung, um pharmakologische Therapieansätze zu entwickeln, die der Heilung oder der Linderung der Krankheitssymptome dienen.
| Wirbeltiere | Wirbellose |
|---|---|
| Histamin | Histamin |
| Serotonin | Serotonin |
| Dopamin | Dopamin |
| Noradrenalin | Tyramin |
| Adrenalin | Octopamin |
Tabelle 1: Liste der wichtigsten biogenen Amine in Wirbeltieren und Wirbellosen.
Strukturelle Eigenschaften der biogenen Amin-Rezeptoren
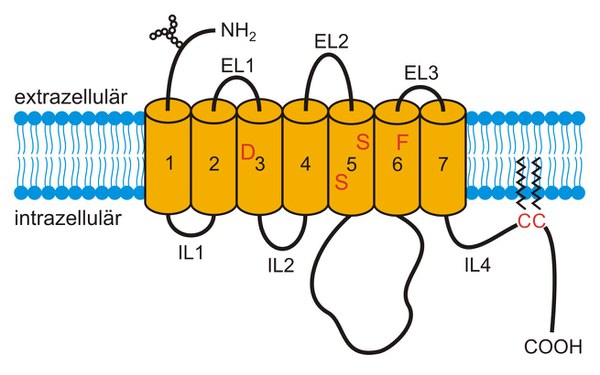
Biogene Amin-Rezeptoren gehören überwiegend zur Supergenfamilie der GPCR. Innerhalb dieser Genfamilie werden sie der größten Untergruppe zugeordnet, den sogenannten Rhodopsin-ähnlichen Rezeptoren. Alle Mitglieder dieser Gruppe sind integrale Membranproteine. Ein charakteristisches Merkmal der Proteine ist, dass sie sieben Transmembransegmente (TM) besitzen (Abbildung 2). Die TM sind durch jeweils drei alternierende extrazelluläre (EL) und intrazelluläre Schleifen (IL) miteinander verbunden. Cystein Reste im zytoplasmatischen Endabschnitt der Proteine können posttranslational palmitoyliert werden. Die Insertion der Palmitinsäuren in die Plasmamembran führt zur Ausbildung einer vierten intrazellulären Schleife (IL4), die die Struktur des Rezeptors stabilisiert. Die Aktivierung der Rezeptoren erfolgt durch die Bindung des spezifischen biogenen Amins. Die Interaktion zwischen dem Ligand und dem Rezeptorprotein findet in einer Bindestelle statt, die von den TM gebildet wird. Spezifische Aminosäuren aus unterschiedlichen TM interagieren dabei mit den funktionellen Gruppen der biogenen Amine. Insbesondere eine Asparaginsäure (D) in TM3, Serine (S) in TM5 und ein Phenylalanin (F) in TM6 bestimmen die Bindungseigenschaften der Rezeptoren. Aufgrund der Ligandenbindung kommt es zu einer Konformationsänderung des Rezeptors. Diese Strukturänderung wird intrazellulär an G-Proteine weitergegeben. Aminosäuren, die sich in der Nähe der Plasmamembran in IL2, 3 und 4 befinden, sind entscheidend für die Spezifität und Effizienz der G-Protein Aktivierung. Die Rezeptor-vermittelte Signalkaskade kann durch die Phosphorylierung der Rezeptoren an Serin und Threonin Resten in der IL3 und im C-Terminus wieder abgeschaltet werden.
Biogene Amine regulieren unterschiedliche zelluläre Signalwege
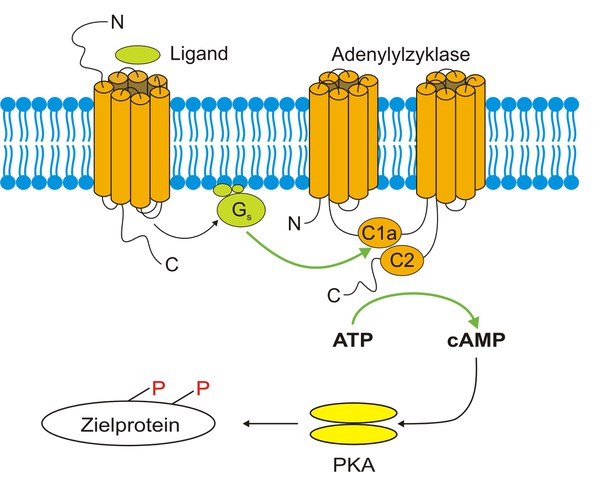
Aufgrund pharmakologischer Untersuchungen ist bekannt, dass die einzelnen biogenen Amine meistens mehrere Rezeptorsubtypen aktivieren können. Diese Daten wurden durch die Klonierung der Gene, die z.B. für unterschiedliche Dopamin- oder Serotoninrezeptoren kodieren, bestätigt. Generell kann die Aktivierung eines GPCR Änderungen der intrazellulären cAMP ([cAMP]i) und/oder Ca2+([Ca2+]i) Konzentration auslösen. Man benutzt die zellulären Antworten auch zur funktionellen Klassifizierung der Rezeptorsubtypen. Nach einer GPCR Aktivierung kann die [cAMP]i entweder ansteigen oder abnehmen (Abbildung 3). Die jeweilige Antwort hängt von der spezifischen Wechselwirkung des Rezeptors mit dem G-Protein ab. Bindet der Rezeptor an ein Gs-Protein, so stimuliert die aktivierte Gas-Untereinheit membranständige Adenylylzyklasen (AC), die cAMP aus ATP synthetisieren. Der Anstieg des [cAMP]i kann cAMP-abhängige Proteinkinasen (Proteinkinase A, PKA) aktivieren, die wiederum verschiedene Proteine phosphorylieren. Die Aktivierung anderer Rezeptorsubtypen durch das gleiche biogene Amin kann aber auch Adenylylzyklasen inhibieren (Abbildung 4). Dieser Effekt beruht auf der Interaktion des Rezeptors mit inhibitorischen G-Proteinen (Gi).

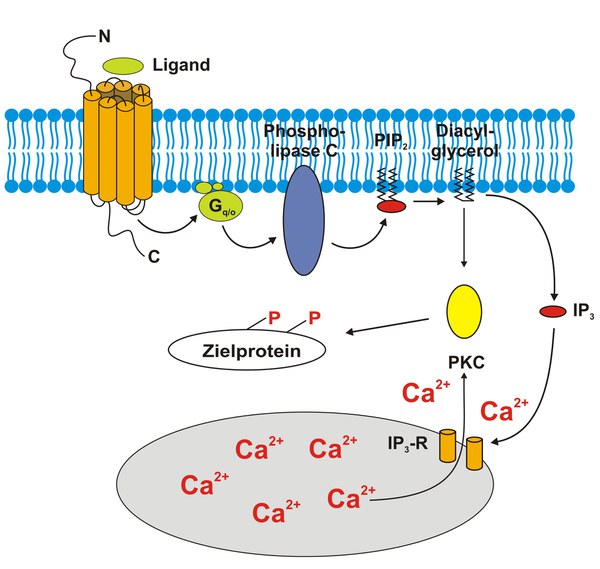
Ein anderer Signalweg, der von GPCR gesteuert wird, führt zu einem Anstieg der [Ca2+]i (Abbildung 5). In diesem Fall bindet der Rezeptor an G-Proteine der Gq/o Familie. Die aktivierten Gαq/o Untereinheiten stimulieren die Phospholipase C (PLC). Das Enzym spaltet das membranständige Substrat Phosphatidylinositol 4,5-bisphosphat (PIP2). Dabei entstehen die sekundären Botenstoffe IP3 und DAG. Das IP3 diffundiert frei im Zytoplasma und bindet an spezifische IP3 Rezeptoren im Endoplasmatischen Retikulum. Die IP3 Rezeptoren sind ionotrope Ca2+-Kanäle. Nach der Bindung von IP3 fließt Ca2+ aus dem Endoplasmatischen Retikulum ins Zytoplasma. Neben der Erhöhung der [Ca2+]i kann im Zusammenspiel mit dem in der Plasmamembran verbliebenen DAG die Proteinkinase C (PKC) aktiviert werden. Ähnlich wie bereits für PKA beschrieben, kann auch die PKC viele Proteine an Serin und Threonin Resten phosphorylieren und so deren funktionelle Eigenschaften modulieren.
Biogene Amine in Insekten
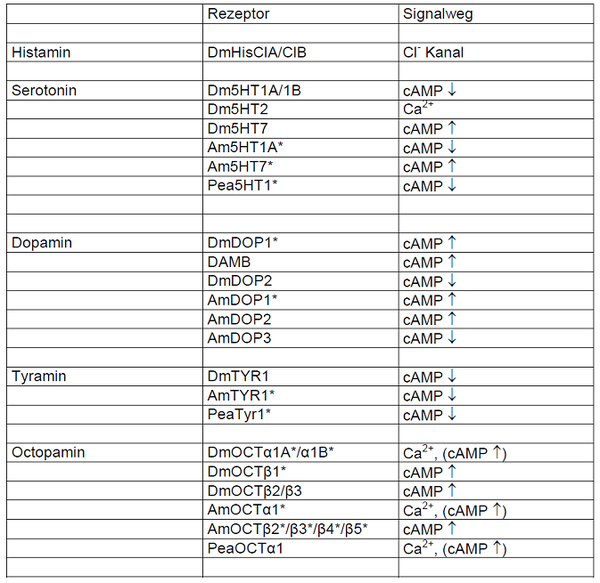
In den letzten Jahren wurde ein enormer Fortschritt im Verständnis der molekularen und funktionellen Eigenschaften biogener Amin-Rezeptoren von Wirbellosen erzielt. Unsere eigenen Arbeiten haben entscheidend dazu beigetragen, biogene Amin-Rezeptoren der Fruchtfliege (Drosophila melanogaster), der Honigbiene (Apis mellifera) sowie der Amerikanischen Küchenschabe (Periplaneta americana) zu identifizieren und umfassend zu charakterisieren. In der nachstehenden Tabelle sind die Rezeptoren der drei Spezies aufgeführt, die bisher kloniert und funktionell untersucht wurden.
Publikationen zum Thema:
Bockaert, J. and Pin, J.-P. (1999)
Molecular tinkering of G protein-coupled receptors: an evolutionary success.
EMBO J. 18, 1723 - 1729.
Filipek, S., Teller, D.C., Palczewski, K., and Stenkamp, R. (2003)
The crystallographic model of rhodopsin and its use in studies of other G protein-coupled receptors.
Annu. Rev. Biophys. Biomol. Struct. 32, 375-397.
Blenau, W., Erber, J. and Baumann, A. (1998)
Characterization of a dopamine D1 receptor from Apis mellifera: Cloning, functional expression, pharmacology, and mRNA localization in the brain.
J. Neurochem. 70, 15-23.
Blenau, W., Balfanz, S. and Baumann, A. (2000)
Amtyr1: Characterization of a gene from honeybee (Apis mellifera) brain encoding a functional tyramine receptor.
J. Neurochem. 74, 900-908.
Blenau, W. and Baumann, A. (2001)
Molecular and pharmacological properties of insect biogenic amine receptors: lessons from Drosophila melanogaster and Apis mellifera.
Arch. Insect Biochem. Physiol. 48, 13-38.
Grohmann, L., Blenau, W., Erber, J., Ebert, P.R., Strünker, T. and Baumann, A. (2003)
Molecular and functional characterization of an octopamine receptor from honeybee (Apis mellifera) brain.
J. Neurochem. 86, 725-735.
Balfanz, S., Strünker, T., Frings, S. and Baumann, A. (2005)
A family of octopamine receptors that specifically induce cyclic AMP production or Ca2+release in Drosophila melanogaster.
J. Neurochem. 93, 440-451.
Scheiner, R., Baumann, A. and Blenau, W. (2006)
Aminergic control and modulation of honeybee behavior.
Curr. Neuropharmacol. 4, 259-276
Schlenstedt, J., Balfanz, S., Baumann, A. and Blenau, W. (2006)
Am5-HT7: molecular and pharmacological characterization of the first serotonin receptor of the honeybee (Apis mellifera).
J. Neurochem. 98, 1985-1998
Rotte, C., Krach, C., Balfanz, S., Baumann, A. and Blenau, W. (2009)
Molecular characterization and localization of the first tyramine receptor of the American cockroach (Periplaneta americana).
Neuroscience 162, 1120-1133
Thamm, T., Balfanz, S., Scheiner, R., Baumann, A. and Blenau, W. (2010)
Characterization of the 5-HT1Areceptor of the honeybee (Apis mellifera) and involvement of serotonin in phototactic behavior.
Cell. Mol. Life Sci. 67, 2467-2479
