Guanylyl- und Adenylylzyklasen
Zyklische Nukleotide
Die zyklischen Nukleotide 3',5'-zyklisches Guanosin-Monophosphat (cGMP) und 3',5'-zyklisches Adenosin-Monophosphat (cAMP) sind wichtige sekundäre Botenstoffe (‘second messenger’). Diese Moleküle regulieren auf vielfältige Weise zelluläre Signalprozesse. cGMP wird aus GTP und cAMP aus ATP von spezifischen Enzymen, Guanylylzyklasen (GCs) bzw. Adenylylzyklasen (ACs), synthetisiert. Werden diese Enzyme aktiviert, steigt die intrazelluläre Konzentration der zyklischen Nukleotide an. Phosphodiesterasen (PDE) sind Enzyme, die cGMP und cAMP zu GMP bzw. AMP abbauen und dadurch die intrazelluläre Ruhekonzentration der zyklischen Nukleotide wieder herstellen können. Im Folgenden werden charakteristische Eigenschaften von GCs und ACs sowie Funktionen von cGMP und cAMP bei der zellulären Signalverarbeitung und unsere Forschungsinteressen hinsichtlich dieser Moleküle vorgestellt.
Guanylylzyklasen
Guanylylzyklasen (GCs) sind Schlüsselenzyme in cGMP-vermittelten Signalwegen. In Säugetieren wurden sieben Gene identifiziert, die für GCs mit einer membrandurchgängigen Domäne kodieren. Darüber hinaus ist eine im Zytosol lokalisierte lösliche Form der GC (sGC) bekannt. Die membrangebundenen GCs werden als GC-A bis GC-G abgekürzt; sie zeigen die gleiche strukturelle Topologie (Abb.1).
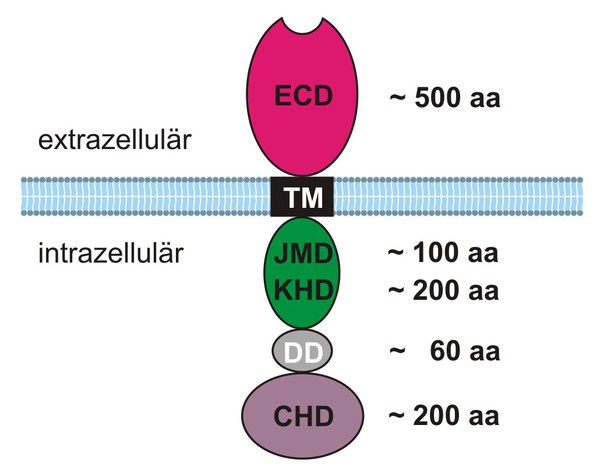
Ein einziges Transmembransegment (TM) verbindet die extrazellulär gelegene Liganden Binde Domäne (ECD) mit dem intrazellulär gelegenen Proteinteil, der im wesentlichen aus der Kinase-Homologie-Domäne (KHD), der Dimerisierungsregion (DD) und der Zyklase-Homologie-Domäne (CHD) besteht. Die CHD beherbergt die Bindestelle für GTP, das Substrat der GC.
Säugetier GCs lassen sich aufgrund von Aminosäuresequenz-Ähnlichkeiten in drei Unterfamilien einteilen. Die erste Gruppe umfasst GC-A, -B und -G, die zweite GC-D, -E und -F, wohingegen GC-C das einzige Mitglied der dritten Gruppe ist. Eine alternative Einteilung basiert auf funktionellen und regulatorischen Eigenschaften der Enzyme: GC-A, -B und -C werden als Rezeptor-GCs bezeichnet und GC-D, -E and -F als neuronale GCs (Wedel, 2001).
GCs werden durch verschiedene Liganden aktiviert. Rezeptor GCs binden Natriuretische Peptide (GC-A, -B) oder Guanylin Peptide sowie bakterielle hitzestabile Enterotoxine (GC-C). Das von den GCs synthetisierte cGMP kontrolliert z. B. den Blutdruck und die Harnsekretion (GC-A, -B) oder den Wasser- und Elektrolyt-Haushalt in den Geweben (GC-C). Die GC-D kommt in einer speziellen Subpopulation von Riechzellen vor. Die Aktivität der GC-D kann intrazellulär durch kleine Ca2+-Bindeproteine (myr-neurocalcin, GCAP-1) oder extrazellulär durch verschiedene Liganden (Uroguanylin; CO2/Hydrogencarbonat) reguliert werden. Man nimmt an, dass die Riechzellen, die GC-D exprimieren, an der Wahrnehmung von Semiochemikalien beteiligt sind. Photorezeptorzellen in der Netzhaut exprimieren GC-E und –F (Koch et al., 2002). Diese werden durch Ca2+-Bindeproteine aktiviert und „versorgen“ die Photorezeptorzellen mit cGMP, das an zyklisch Nukleotid-gesteuerte (CNG) Ionenkanäle in der Plasmamembran bindet und dadurch die Kanäle öffnet. Über die Funktion der GC-G, die in verschiedenen Geweben exprimiert wird, ist noch wenig bekannt.
Aktivierung membrangebundener GCs
In Abwesenheit eines Liganden bilden membrangebundene GCs Homo-Dimere oder Homo-Trimere (GC-C). Biochemische und strukturelle Untersuchungen zeigten, dass spezifische Regionen des extra- und des intrazellulären Proteinbereichs an der Oligomerisierung von GC-Molekülen beteiligt sind. Eine Abfolge von 43 Aminosäuren ist in der intrazellulären ‚hinge’ Region aller Säugetier-GCs konserviert (Abb. 1, DD Region). Dieses Segment bildet eine amphipathische Helix aus, die die Assoziation und/oder Oligomerisierung von GC-Untereinheiten begünstigt. Die Bindung des Liganden an die ECD löst eine Konformationsänderung in der ‚hinge’ Region aus. Es ist noch nicht genau bekannt, wie die Liganden-Bindung zur Aktivierung der GC führt. Man postuliert, dass die Liganden-Bindung eine Bindung von ATP an die KHD ermöglicht. Hat ATP gebunden, kommt es zu Konformationsänderungen in der KHD, was drei Vorgänge nach sich zieht: (1) Der inhibitorische Effekt der KHD auf die katalytische Aktivität der GC wird geschmälert. Die katalytischen Domänen wechselwirken miteinander und bilden zwei aktive Zentren pro GC-Dimer. Die Synthese von cGMP beginnt. (2) Eine gesteigerte Dissoziationsrate reduziert die Affinität der ECD für ihren Liganden. (3) Phosphorylierte Aminosäuren in der KHD werden exponiert und können entweder von nicht-spezifischen oder cGMP-abhängigen Phosphatasen dephosphoryliert werden. Die Dephosphorylierung inaktiviert die GC. In der Tat, im Ruhezustand sind GC-A und -B in der KHD phosphoryliert. Im Gegensatz zu den Rezeptor-GCs wird die Aktivität der neuronalen GCs hauptsächlich durch die intrazelluläre Ca2+-Konzentration reguliert.
cGMP-vermittelte Signaltransduktion in Säugetieren
Die Signaltransduktion in Sehzellen der Wirbeltiernetzhaut dient seit langem als ein Modellsystem, um cGMP-vermittelte Signalwege zu verstehen. Die molekularen Mechanismen der Phototransduktion sind an anderer Stelle unserer home page detailliert beschrieben.
Ein weiterer, ziemlich ungewöhnlicher cGMP-vermittelter Signalweg kommt in einer kleinen Subpopulation von olfaktorischen sensorischen Neuronen (OSN) vor. In der überwiegenden Mehrzahl der OSN beginnt die Signaltransduktion damit, dass Duftstoffmoleküle an G-Protein gekoppelte Duftstoff-Rezeptoren binden. Die aktivierten Rezeptoren interagieren mit stimulatorischen G-Proteinen, die, indem sie Adenylylzyklasen aktivieren, die Synthese von cAMP auslösen. Der Anstieg der cAMP-Konzentration führt dazu, dass cAMP-gesteuerte Ionenkanäle öffnen, Na+- und Ca2+-Ionen einströmen und dadurch das Membranpotential der OSN depolarisiert.
Eine kleine Subpopulation der OSN verwendet einen alternativen Signalweg. Diese OSN exprimieren die GC-D, eine cGMP-abhängige Form der Phosphodiesterase (PDE2) und einen CNG-Ionenkanal, der deutlich selektiver für cGMP als für cAMP ist. Alle Komponenten des prototypischen cAMP-Signalwegs fehlen in dieser OSN-Subpopulation. In diesen Riechzellen ist offensichtlich cGMP der entscheidende sekundäre Botenstoff. Abbildung 2 zeigt den entsprechenden Signalweg.
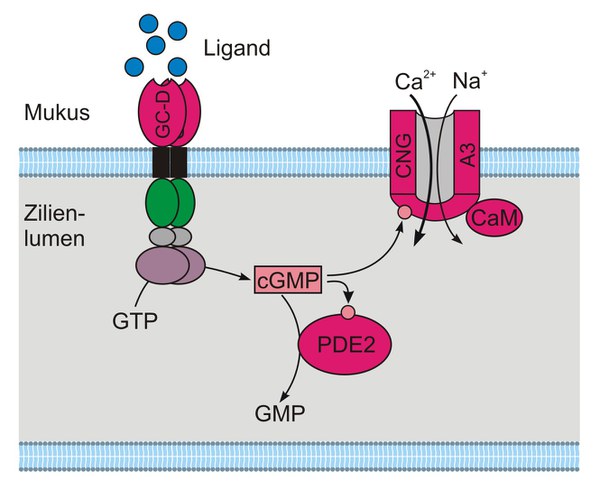
Es wird vermutet, dass die Aktivierung der GC-D zur Synthese von cGMP führt. Die cGMP-Konzentration steigt an, CNG-Ionenkanäle in der Plasmamembran öffnen (Meyer et al., 2000), Na+- und Ca2+-Ionen strömen in die Zelle ein und das Membranpotential depolarisiert. Die CNG Kanal-Untereinheit A3 ist auch in Zapfensehzellen exprimiert (Weyand et al., 1994). Sie ist ~200-fach empfindlicher für cGMP als cAMP. Der Signalweg wird dadurch abgeschaltet, dass die PDE2 cGMP zu GMP hydrolysiert. Der CNG-Kanal schließt und die Zelle kehrt zum Ruhe-Membranpotential zurück. Die Aktivität des CNG-Kanals kann durch Ca2+/Calmodulin moduliert werden. Allerdings ist die CNGA3-Untereinheit wesentlich unempfindlicher für Calmodulin als der prototypische olfaktorische CNG-Kanal, der aus anderen CNG-Kanaluntereinheiten aufgebaut ist (Meyer et al., 2000; Bradley et al., 2004).
Jüngste Arbeiten zeigen, dass ein verblüffend ähnlicher cGMP-Signalweg in einem anderen olfaktorischen Organ, den Grüneberg-Ganglien, vorkommt (siehe Zufall & Munger, 2010). Grüneberg-Ganglien exprimieren neben der PDE2 und der CNGA3-Untereinheit ebenfalls eine membrangebundene GC, die GC-G.
Lösliche Guanylylzyklasen
Lösliche GCs unterscheiden sich deutlich in ihren strukturellen und regulatorischen Eigenschaften von membrangebundenen GCs. Lösliche GCs sind Hetero-Dimere (α- und β-Untereinheit) und besitzen eine prosthetische Hämgruppe. In Säugetieren kommen mindestens zwei Isoformen jeder Untereinheit vor (α1, α2 und β1, β2). Lösliche GCs werden durch Stickstoffmonoxid (NO) aktiviert. Dieses hochreaktive Gas wird von der NO-Synthase (NOS), die L-Arginin in L-Citrullin umwandelt, synthetisiert. NO bindet an das zentrale Eisenatom der Hämgruppe der sGC. Das Holoenzym enthält nur eine Hämgruppe im N-terminalen Bereich der β-Untereinheit der sGC. Die katalytische Domäne wird von den C-terminalen Bereichen der α- und β-Untereinheiten gebildet. Der genaue Aktivierungsmechanismus der sGC durch NO ist immer noch Gegenstand der Diskussion (siehe Poulos, 2006). Man nimmt an, dass die Bindung von NO zu Konformationsänderungen des Proteins führt, sodass die katalytischen Domänen beider Untereinheiten wechselwirken und so das aktive Zentrum des Enzyms ausbilden können. Wichtige physiologische Prozesse wie Relaxation der glatten Muskulatur, Gefäßerweiterung, Verhinderung der Thrombozyten-Aggregation und Signalübertragung zwischen Nervenzellen werden durch sGCs reguliert.
Guanylylzyklasen kommen nicht nur in Säugetieren vor. Sie wurden in vielen Organismen, unter anderem auch in Bakterien und Pflanzen sowie verschiedenen Invertebraten identifiziert und charakterisiert. Ein gut untersuchtes Beispiel für eine Invertebraten-GC ist die membrangebundene GC aus Seeigel-Spermien, die als Rezeptor für Lockstoffpeptide, die von Eizellen ausgeschüttet werden, dient (siehe Kaupp et al., 2008). Signalwege, die cGMP als zentralen sekundären Botenstoff verwenden, sind also evolutionär konserviert und weit verbreitet.
Adenylylzyklasen
Enzyme, die 3',5'-zyklisches Adenosin-Monophosphat (cAMP) aus ATP herstellen, nennt man Adenylylzyklasen (ACs). Genauso wie GCs, kommen ACs als integrale Membranproteine sowie als zytosolische, lösliche Proteine vor. In Wirbeltieren kennt man neun membrangebundene und eine zytosolische AC (Sunahara & Taussig, 2002). Alle membrangebundenen ACs besitzen eine gemeinsame und charakteristische Topologie (Abbildung 3).
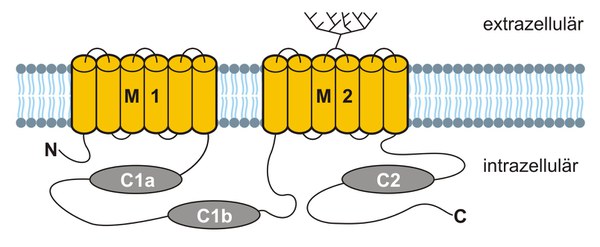
Ein relativ kurzer, intrazellulärer N-terminaler Bereich (N) wird von einer hydrophoben Domäne, die als 'Membrandomäne' (M1) bezeichnet wird, gefolgt. In M1 durchspannt die Polypeptidkette sechsmal die Plasmamembran. Die anschließende zytosolische Schleife beherbergt die erste Zyklase Homologie Domäne (CHD; C1a) und die Regulatorische Domäne (C1b). An die Schleife schliesst sich eine zweite ‚Membrandomäne’ (M2) an, in der die Polypeptidkette wiederum sechsmal die Plasmamembran durchspannt. Die anschließende zytosolische Schleife enthält die zweite CHD (C2) und das C-terminale Ende (C) des Proteins.
Membrangebundene ACs fungieren als nachgeschaltete Zielproteine in Signalwegen, die von G-Protein gekoppelten Rezeptoren aktiviert werden, z. B. in der Olfaktion. Membrangebundene ACs werden durch α-Untereinheiten stimulatorischer G-Proteine (Gαs) aktiviert. Damit cAMP aus ATP synthetisiert werden kann, müssen C1a und C2 miteinander wechselwirken (Abb. 4). Die αs-Untereinheit des G-Proteins stabilisiert das C1a/C2-Dimer und dadurch die katalytische Aktivität des Enzyms. Forskolin, ein pflanzliches Diterpen, vermag ebenfalls die Interaktion von C1a und C2 auszulösen. Deshalb wird Forskolin oft verwendet, um membrangebundene ACs zu aktivieren. Die α-Untereinheiten von inhibitorischen G-Proteinen (Gαi) können auch an das C1a/C2-Dimer binden. Die Bindung von Gαi reduziert allerdings die Affinität zwischen C1a und C2 und das Enzym wird inhibiert.
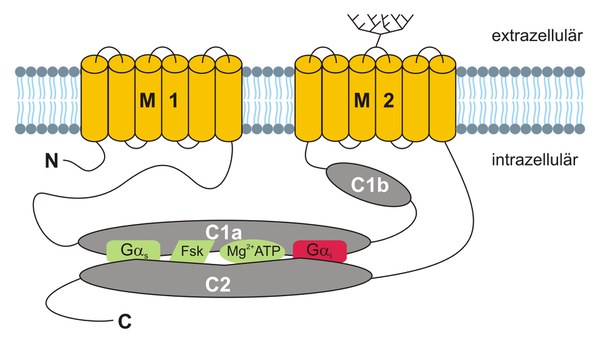
Gemäß ihrer Aminosäuren-Sequenz Homologie und Regulation der enzymatischen Aktivität werden membrangebundene ACs in fünf Gruppen eingeteilt.
Alle membrangebundenen ACs werden durch Gαs aktiviert. ACs werden auch durch Forskolin stimuliert, außer ACIX und der zytosolischen ACX. Darüber hinaus kann die Aktivität der ACs durch verschiedene Proteinkinasen und durch Ca2+/Calmodulin reguliert werden. Adeninnukleosid-3'-polyphosphate (‘P-site Analoge’) sind sehr potente Inhibitoren membrangebundener ACs (Tabelle 1). Biochemische Hinweise für eine zytosolische AC gab es schon seit Mitte der 70iger Jahre des letzten Jahrhunderts; erst mehr als zwanzig Jahre später wurde das Gen der sAC kloniert (Buck et al., 1999). Ursprünglich in Säugetier-Spermien identifiziert, wird die zytosolische AC mittlerweile in vielen Körperzellen nachgewiesen. Die lösliche AC wird durch Hydrogencarbonat (‚Bicarbonat’) und Ca2+ aktiviert (Litvin et al., 2003).
Rolle von cAMP-vermittelten Signalwegen bei der neuronalen Plastizität
Die hauptsächliche Funktion von cAMP in der zellulären Signalverarbeitung besteht darin, die Proteinkinase A (PKA) zu aktivieren und Ionenkanäle zu öffnen bzw. deren Aktivität zu regulieren (Taylor et al., 2004; Kaupp & Seifert, 2002). PKA phosphoryliert viele membrangebundene und lösliche Proteine und reguliert dadurch deren Eigenschaften. Einige Zielproteine der PKA sind Transkriptionsfaktoren wie CREB (cAMP responsive element binding protein) oder G-Protein gekoppelte Rezeptoren. CREB wird durch Phosphorylierung aktiviert. Es bindet an spezifische Sequenzbereiche in der Promoterregion bestimmter Gene. Das Gen wird transkribiert und schließlich das Protein synthetisiert. Die Phosphorylierung von GPCRs ist ein wichtiger Schritt, um zelluläre Signalkaskaden abzuschalten. Die Rezeptoren desensitisieren und die Signaltransduktion endet.
Extrazelluläre Signale, die die Aktivität von ACs ändern, kontrollieren nicht nur die intrazelluläre cAMP-Konzentration, sondern vermögen auch das Signalverhalten einer Zelle zu beeinflussen. ACs, die vielfältig reguliert werden können, sind dazu geeignet, Informationen aus verschiedenen Stoffwechselwegen zu erkennen und so umzuwandeln, dass sich das Signalverhalten zwischen einzelnen Neuronen und/oder die Struktur der Synapse langfristig ändern. Dieses Phänomen ist als "Neuronale Plastizität" bekannt. Derartige Prozesse finden beim Lernen und der Gedächtnisbildung von Tieren statt (siehe Kandel, 2001).
Die molekularen und zellulären Mechanismen, die Lernen und Gedächtnis zu Grunde liegen, werden seit vielen Jahren intensiv erforscht. Diesbezüglich ist die Honigbiene Apis mellifera ein einzigartiges Modellsystem. Honigbienen verfügen über ein enormes Verhaltensrepertoir. Unterschiedliche Verhaltensweisen können unter Laborbedingungen wie auch in Feldversuchen untersucht werden (Menzel, 2001). Obwohl das Honigbienen-Verhalten intensiv untersucht worden ist, steckt die genaue Kenntnis der molekularen Komponenten, die an der neuronalen Signalverarbeitung beteiligt sind, noch in den Kinderschuhen. Nachdem wir verschiedene GPCRs kloniert und pharmakologisch charakterisiert haben, konnten wir kürzlich das Gen einer membrangebundenen AC aus der Honigbiene klonieren (AmAC3; Wachten et al., 2006). Momentan untersuchen wir die biochemischen und pharmakologischen Eigenschaften nativer als auch heterolog exprimierter und ACs mit dem Ziel, die physiologische Bedeutung der AmAC3 im Gehirn der Honigbiene genauer zu verstehen.
Publikationen zum Thema aus unserem Institut:
Bradley, J., Bönigk, W., Yau, K.W., Frings, S.
'Calmodulin permanently associates with rat olfactory CNG channels under native conditions.'
Nature Neuroscience 7 (2004) S. 705-710
Kaupp U.B., Seifert, R.
'Cyclic nucleotide-gated ion channels.'
Physiological Reviews 82 (2002) S. 769-824
Kaupp, U.B., Kashikar, N.D., Weyand, I.
'Mechanisms of sperm chemotaxis'
Annual Review of Physiology 70 (2008), S. 93-117
Koch, K.-W., Duda, T., Sharma, R.K.
'Photoreceptor specific guanylate cyclases in vertebrate phototransduction.'
Molecular & Cellular Biochemistry 230 (2002) S. 97-106
Meyer, M.R., Angele, A., Kremmer, E., Kaupp, U.B., Müller, F.
'A cGMP-signaling pathway in a subset of olfactory sensory neurons.'
Proceedings of the National Academy of Sciences of the USA 97 (2000) S. 10595-10600
Wachten, S., Schlenstedt, J., Gauss, R., Baumann, A.
'Molecular identification and functional characterization of an adenylyl cyclase from the honeybee.'
Journal of Neurochenmistry 96 (2006) S. 1580-1590
Weyand I., Godde M., Frings S., Weiner J., Müller F., Altenhofen W., Hatt H., Kaupp U.B.
'Cloning and functional expression of a cyclic-nucleotide-gated channel from mammalian sperm.'
Nature 368 (1994) S. 859-863
Andere Arbeiten:
Buck, J., Sinclair, M.L., Schapal, L., Cann, M.J., Levin, L.R.
'Cytosolic adenylyl cyclase defines a unique signaling molecule in mammals'
Proceedings of the National Academy of Sciences of the USA 96 (1999) S. 79-84
Kandel, E.R.
'The molecular biology of memory storage: A dialogue between genes and synapses.'
Science 294 (2001) S. 1030-1038
Litvin, T.N., Kamenetsky, M., Zarifyan, A., Buck, J., Levin, L.R.
'Kinetic properties of "soluble" adenylyl cyclase.'
Journal of Biological Chemistry 278 (2003) S. 15922-15926
Menzel, R.
'Searching for the memory trace in a mini-brain, the honeybee'
Learning & Memory 8 (2001) S. 53-62
Poulos, T.L.
'Soluble guanylate cyclase'
Current Opinion in Structural Biology 16 (2006) S. 736-743
Sunahara, R.K., Taussig, R.
'Isoforms of mammalian adenylyl cyclase: multiplicities of signaling.'
Molecular Interventions 2 (2002) S. 168-743
Taylor, S.S., Yang, J., Wu, J., Haste, N.M., Radzio-Andzelm, E., Anand, E.
'PKA: a portrait of protein kinase dynamics.'
Biochimica et Biophysica Acta 1697 (2004) S. 259-269
Wedel, B.J., Gabers, D.L.
'The guanylyl cyclase family at y2k'
Annual Review of Physiology 63 (2001) S. 215-233
Zufall, F., Munger, S.D.
'Receptor guanylyl cyclases in mammalian olfactory function'
Molecular and Cellular Biochemistry 334 (2010) S. 191-197
