Fluoreszierende Proteine in neuen Farben
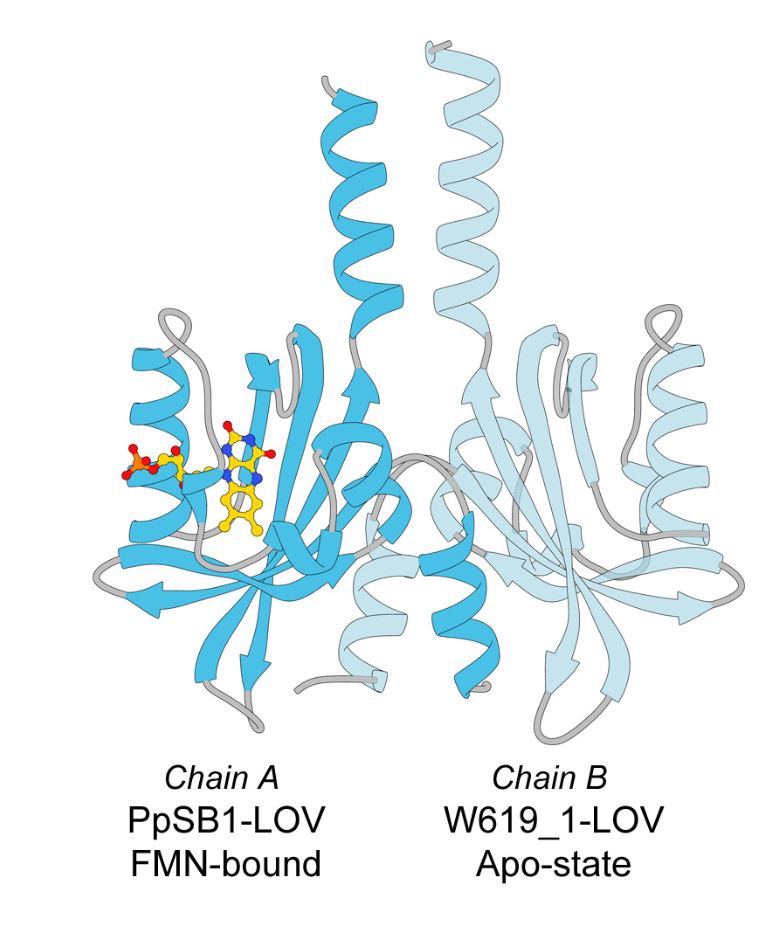
24. Februar 2017 – Forschern aus Jülich und Düsseldorf ist ein wichtiger Schritt gelungen, um sogenannte LOV-Proteine in Zukunft noch besser für biotechnologische Anwendungen nutzbar zu machen. In Pflanzen- und Bakterienzellen regulieren diese leuchtenden Eiweißmoleküle viele vom Licht abhängige Prozesse. Sie haben aber auch günstige Eigenschaften für unterschiedliche lichtbasierte Anwendungen. So können sie unter anderem als neue Klasse von Markierungsmolekülen dienen, um zelluläre Prozesse mithilfe der Fluoreszenzmikroskopie zu analysieren. Seit einigen Jahren arbeiten Forscher daher gezielt darauf hin, LOV-Proteine für Anwendung wie diese zu optimieren.
Bisher gab es dabei eine wichtige Einschränkung: Alle bekannten LOV-Proteine reagierten nur auf eine Lichtfarbe – Blaulicht. Der Grund dafür liegt in der molekularen Struktur. Die Proteine kommen in der Natur stets fest verbunden mit einem bestimmten lichtempfindlichen Element vor, das Licht absorbiert und als Fluoreszenz-Licht wieder abstrahlt. Diese sogenannten „Chromophore“ reagieren bei ihnen nur auf einen relativ engen Bereich des Lichtwellenspektrums.
Ein Forscherteam unter Leitung von Jülicher Strukturbiologen am ICS-6 hat jetzt eine Möglichkeit entdeckt, wie andere Farbvarianten hergestellt werden können. Sie konnten erstmals zeigen, dass eine LOV-Variante aus einem Bodenbakterium auch ohne das Blaulicht-sensitive Molekül stabil ist. Anschließend stellten sie gezielt eine Form des Proteins her, die sich mit verschiedenen anderen natürlichen und künstlich veränderten Chromophor-Molekülen kombinieren lässt, die auf andere Bereiche des Lichtspektrums reagieren. Das breitere Farbspektrum könnte es nun ermöglichen, mit unterschiedlichen LOV-Varianten gleichzeitig verschiedene Bestandteile und Prozesse in Zellen unter dem Fluoreszenzmikroskop zu analysieren.
Das Projekt wurde durch das Förderprogramm „Optosys“ des Bundesministeriums für Bildung und Forschung (BMBF) finanziert.
Originalveröffentlichung:
Vladimir Arinkin, Joachim Granzin, Katrin Röllen, Ulrich Krauss, Karl-Erich Jaeger, Dieter Willbold and Renu Batra-Safferling: Structure of a LOV protein in apo-state and implications for construction of LOV-based optical tools. Scientific Reports 7, Article number: 42971 (2017); DOI: 10.1038/srep42971
http://www.nature.com/articles/srep42971
Die Struktur in der RCSB Protein Data Bank:
http://www.rcsb.org/pdb/explore/explore.do?structureId=5LUV
Weitere Informationen:
Arbeitsgruppe Structural Studies on Biological Photoreceptors (Leitung PD Dr. Renu Battra-Safferling und PD Dr. Joachim Granzin)
Pressekontakt:
Peter Zekert
Institute of Complex Systems, Strukturbiochemie (ICS-6)
Tel: +49 2461 61-9711
E-Mail: p.zekert@fz-juelich.de
