GABARAP-Ligand-Interaktionen
Einblick in die Besonderheiten der GABARAP Liganden wurde zunächst anhand von Phagen-Display-Screening-Experimenten gewonnen. Die Mehrheit der GABARAP-bindenden Peptide enthalten mindestens einen Tryptophanrest. Da die Seitenkette von Tryptophan eine starre, aromatische Indol-Einheit enthält, wurden Indolderivate wie Indol-Essigsäure (IAA) verwendet, um die Bindungseigenschaften von GABARAP mittels zweidimensionaler NMR-Spektroskopie zu charakterisieren. Hierbei wurden zwei apolare Bereiche auf der Oberfläche von GABARAP mit einer deutlichen Affinitäten zu IAA identifieziert. Diese Bereiche wurden hydrophoben Tasche 1 (HP1) und HP2 genannt.
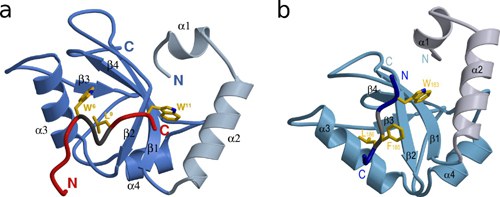
Kürzlich konnten wir mit Hilfe der Röntgenkristallographie strukturelle Informationen über die Interaktionen von GABARAP mit artifiziellen sowie physiologischen Liganden erhalten.
Ein GABARAP bindendes Peptid mit der Sequenz DATYTWEHLAWP (sog. K1) konnte mehrfach bei Phagen-Display-Screenings gefunden werden. Die dreidimensionale Struktur des GABARAP-K1 - Komplexes wurde mittels Röntgenstrukturanalyse (Abbildung 1a) bestimmt. Dieser Komplex wird durch hydrophobe Interaktionen zwischen dem Tryptophanrest W6 und dem Leucinrest L9, die mit HP2 interagieren, sowie durch die Interaktion des Tryptophanrestes W11 mit HP1 stabilisiert.
Calreticulin ist ein zellulärer Interaktionspartner von GABARAP, der in unserem Labor identifiziert wurde. Calreticulin ist für seine Funktion als Kalzium-abhängiges Chaperon im endoplasmatischen Retikulum bekannt. Es ist zwar meist im ER-Lumen lokalisiert, seine Retrotranslokation zurück ins Cytosol konnte jedoch auch nachgewiesen werden, so dass es dort für die Interaktion mit GABARAP zur Verfügung steht. Tatsächlich ergaben Kolokalisationsstudien ähnliche Verteilungsmuster beider Proteine und rekombinantes GABARAP kann Calreticulin aus Zelllysaten binden.
In einer anschließenden Studie wurden verschiedene Calreticulin Fragmente bezüglich ihrer Interaktion zu GABARAP untersucht. SPR-und NMR-Experimente zeigten, dass das Peptid bestehend aus den Aminosäurenresten 178-188 von Calreticulin (CRT178-188) das primäre Bindungsmotiv enthält, und dass dieses für die Interaktion mit HP1 und HP2 von GABARAP essentiell ist. Die dreidimensionale Struktur des GABARAP - CRT178-188-Komplex wurde ebenfalls mittels Röntgenstrukturanalyse ermittelt (Abbildung 1b). Der zentrale Teil des Peptidliganden bildet Wasserstoffbrücken zum β2-Strang von GABARAP und kann daher als eine intermolekulare Erweiterung des zentralen β-Falttblattes angesehen werden. Insgesamt wird die Interaktion wiederum durch hydrophobe Kontakte der Aminosäurereste W183, F185 und L186 zu GABARAP dominiert.
