Alzheimer – aus Einzelteilen wird ein Bild
Verheerend, niederschmetternd, beängstigend – Worte können kaum ausdrücken, welche Gefühle die Diagnose Alzheimer bei Betroffenen und Angehörigen auslöst. Durch eindrückliche Buchverfilmungen wie "Still Alice – Mein Leben ohne Gestern" oder intensive Erzählungen wie "Langsames Entschwinden", wird es leichter über Demenz offen zu sprechen, Hilfe zu suchen, Pflege zu beantragen. An der momentanen Aussichtslosigkeit der Diagnose ändert das nichts.
Hoffnungsmeldungen über etwaige baldige Therapieoptionen durch Impfstoffe, Antikörper oder vorbeugende Lebens- und Ernährungsweisen mit Sport, Kaffee und Zimt werden regelmäßig durch Nachrichten erschüttert, wenn sich wieder einmal ein großer Pharmakonzern aus der Alzheimerforschung zurückzieht oder vielversprechende Studien abbricht: So wie der Konzern Eli Lilly 2016 nach der Investition von drei Milliarden Dollar und über 27 Jahren Forschungs- und Entwicklungszeit oder Pfizer im Januar 2018, Merck im Februar 2018.
Unbeeindruckt von den Rückschlägen der großen Pharmafirmen bei der Suche nach einer Therapie gegen Alzheimer arbeiten Forscher mit unbeirrbarem Durchhaltewillen daran, die molekularen Grundlagen dieser Krankheit zu verstehen – und dadurch neue Wege der Therapie zu erkunden. So arbeiten etwa am Forschungszentrum Jülich Wissenschaftler und Mediziner sowohl an der Entschlüsselung der an der Krankheit beteiligten Proteinstrukturen, an Therapieoptionen als auch an der frühzeitigen Diagnose.
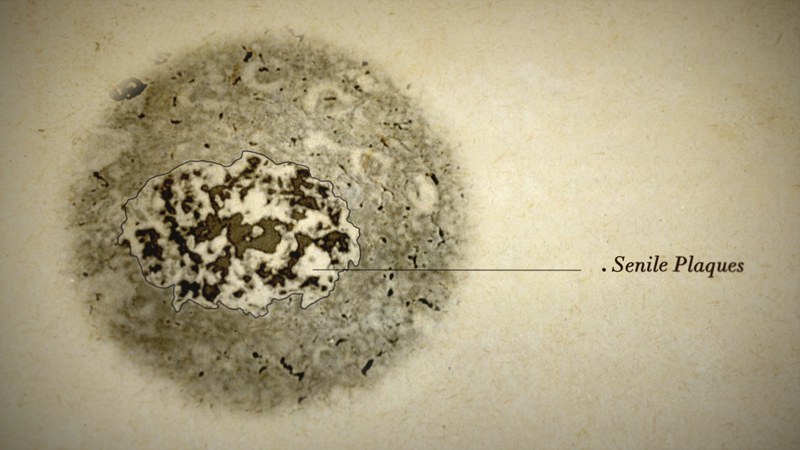
Die Erforschung der Alzheimer'schen Demenz gleicht wegen ihrer Komplexität einem riesigen Puzzlespiel. Das, was der Nervenarzt Dr. Aloïs Alzheimer vor rund 110 Jahren im Mikroskop erblickte, war rückblickend nur eines von vielen kleinen Puzzleteilen in einem unüberschaubaren Bild. Die runden und länglichen Eiweißablagerungen, die er im Gehirn seiner verstorbenen Patientin Auguste Deter entdeckte, und auch der massive Zellschwund waren lediglich die plakativen Begleiterscheinungen eines zerstörerischen Prozesses, der sich schleichend und mit einem herkömmlichen Mikroskop völlig unsichtbar über Jahrzehnte hinweg angebahnt hatte.
Fatale Verkettung
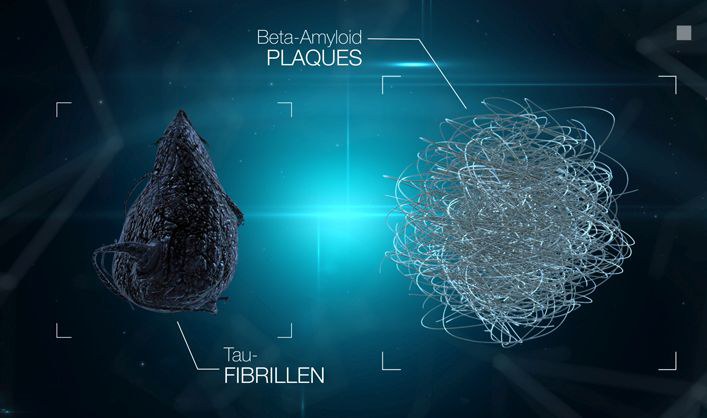
Erst mit Hilfe der fortschreitenden technischen Möglichkeiten in Physik, Chemie und Biologie decken Forscher weltweit Stück für Stück die Funktionen und Wirkungsorte der kleineren Puzzlefragmente im fein abgestimmten Gehirnstoffwechsel auf. Sie erkennen, welche Teile nicht ins Bild passen und damit Krankheiten verursachen. In puncto Alzheimer-Demenz überwiegt in Wissenschaftlerkreisen zurzeit die "Amyloid-Hypothese". Die von Aloïs Alzheimer beschriebenen "Senilen Plaques", die sich außerhalb von Nervenzellen zusammenballen, wurden als Verklumpung von speziellen Eiweißen identifiziert, den Amyloid-beta-Eiweißen. Die von ihm entdeckten "Neurofibrillenbündel", welche sich innerhalb von Nervenzellen verknäueln, bestehen überwiegend aus veränderten Tau-Proteinen. Das sind Proteine, welche im gesunden Zustand Versorgungsbahnen innerhalb von Nervenzellen stützen.

Neuere Untersuchungen legen nahe, dass es im Gehirn der Betroffenen bis zu zwanzig Jahre vor den ersten Symptomen schon zu Amyloid-Ablagerungen kommt. Wichtig sowohl für die Wissenschaft als auch für Patienten ist die Tatsache, dass nicht alle Menschen mit Amyloid-Plaques im Gehirn ebenfalls eine Demenz entwickeln. Erst die Verknäuelung von Tau-Proteinen läutet das irreversible Massensterben von Nervenzellen ein und auch erst jetzt zeigen sich erste geistige Einschränkungen.
Wieso konzentrieren sich trotzdem die häufigsten Therapieansätze auf die Amyloid-Kaskade und nur wenige auf Tau? Wissenschaftler vergleichen Amyloid-beta mit dem Abzug eines Gewehrs und Tau mit der Kugel. Um das Bild zu verstehen, ist es hilfreich zunächst zu betrachten, wie Amyloid-beta im Körper entsteht. Das Molekül wird zeitlebens mithilfe zweier Enzyme aus einem größeren Protein, dem zelleigenen Amyloid-Vorläuferprotein, kurz APP für "amyloid precursor protein", herausgeschnitten. Mutationen in genau diesem Protein können drastische Folgen haben. Es entstehen Amyloid-beta-Varianten mit veränderten Eigenschaften.
Kombination ist gefragt
Während die eine Mutation dazu führt, dass die Betroffenen sehr frühzeitig in ihrem Leben an Alzheimer erkranken, scheint eine kleine isländische Bevölkerungsgruppe durch eine andere Mutation des APP-Proteins beinahe resistent gegen die Krankheit zu sein. Deshalb konzentrieren sich die weitaus meisten Wirkstoffkandidaten entweder darauf Amyloid-beta-Proteine erst gar nicht entstehen zu lassen – indem die beteiligten Enzyme blockiert werden – oder aber auf eine Zerstörung oder Neutralisation der Amyloid-beta-Moleküle. Entstehen bereits Tau-Fibrillen, ist die Krankheit wohlmöglich schon zu weit fortgeschritten, um ihr Einhalt zu gebieten, befürchten die Forscher. Allerdings weisen neue Ergebnisse darauf hin, dass eine Kombinationstherapie, die sowohl Amyloid-beta als auch bestimmte Tau-Varianten ins Visier nimmt, aussichtsreicher ist, als die Konzentration auf ein Molekül alleine.
Jülicher Forscher zielen in ihren Arbeiten zunächst auf Amyloid-beta und besonders auf seine Aggregate. Ihr Wirkstoffkandidat PRI-002 wurde am Forschungszentrum und der Heinrich-Heine-Universität Düsseldorf entwickelt. Er ist in der Lage toxische Zusammenballungen des Amyloid-beta, genannt „Oligomere“, unschädlich zu machen. PRI-002 führte bei Mäusen mit alzheimerähnlichen Symptomen zu einer kognitiven Leistungsverbesserung. Im September 2017 gründete sich die Priavoid GmbH aus dem Forschungszentrum Jülich aus, um den Wirkstoff in Richtung Marktreife zu führen. Nach erfolgreichen präklinischen Sicherheits- und Toxizitätstests startete im April 2018 die klinische Phase-I-Studie, um das potenzielle Alzheimer-Medikament auf seine Sicherheit im Menschen zu prüfen. Aber auch hier ist Geduld gefragt: Bis zu einer möglichen Zulassung eines Medikaments vergehen im Durchschnitt sieben Jahre vom Start einer Phase-I bis zur Marktzulassung.
Risiko steigt im Alter
Während die vererbte Form der Alzheimer Demenz sehr selten ist, gilt als größter Risikofaktor das Alter. Amyloid-beta- Proteine sind als Einzelmoleküle im Normalfall harmlos. Ihnen wird sogar eine schützende Funktion im Nervensystem zugesprochen. Mit fortschreitendem Lebensalter steigt jedoch die Wahrscheinlichkeit, dass das prinzipiell seltene Ereignis eintritt und Amyloid-beta -Proteine beginnen, sich zusammen zu lagern und zwar zu kleinen löslichen – und äußerst toxischen – Aggregaten, den Amyloid-beta-Oligomeren. Sie gelten als wichtige Treiber des Krankheitsgeschehens bei Alzheimer.
Diese Oligomere stehen im Verdacht, Prion-ähnliche Eigenschaften zu besitzen. Das bedeutet, dass sie ihre Fehlfaltung auf andere Amyloid-beta Proteine übertragen können. Und zwar sowohl auf zuvor normal gefaltete Amyloid-beta-Moleküle als auch letztlich auf Tau-Proteine. In einem Schneeballeffekt entstehen weitere Amyloid-beta- und Tau-Oligomere. Fatalerweise haben Tau-Oligomere offensichtlich ebenfalls Prion-ähnliche Eigenschaften und lösen eine weitere Kettenreaktion von krankhaften Fehlfaltungen unter Tau-Proteinen aus. Es erhärtet sich die Vermutung, dass bisherige Therapieansätze, die ausschließlich auf eine Reduktion der Amyloid-beta Proteine zielen, ihre Wirkung verfehlen, weil die verhängnisvolle Kettenreaktion schon längst begonnen hat. In all diesen Szenarien steht am Ende der massenhafte Zelltod.
Kleine Ursache, große Wirkung
Und selbst kleinste Änderungen im Bauplan des Amyloid-beta Moleküls können verheerende Auswirkungen haben, stellten Jülicher Strukturbiologen jüngst in einem internationalen Forschungsprojekt fest. Sie untersuchten eine besonders aggressive Variante des Proteins: "Pyroglutamat-Amyloid-beta", das in extrem hohem Tempo verklumpt, resistent gegen Abbauprozesse ist und dessen Aggregate auf Gehirnzellen extrem toxisch wirken. Pyroglutamat-Amyloid-beta fehlen nur zwei Aminosäuren an einem Ende des Moleküls, eine dritte ist von einem Glutamat zu einem Pyroglutamat umgewandelt. Obwohl diese Änderungen eigentlich eher geringfügig sind, wandeln sich jedoch die biochemischen Eigenschaften dadurch dramatisch. Diese Pyroglutamat-Variante verklumpt mehr als hundertmal schneller zu schädlichen Aggregaten als die "ungekürzte" Form des Amyloid-beta. Daher ist diese Proteinform ein wichtiges Ziel für mögliche Wirkstoffe. Auch der aus Jülich stammende Kandidat PRI-002 kann die Aggregate dieser Amyloid-beta-Variante unschädlich machen.
Diagnose sichern

Um beizeiten in den Krankheitsverlauf eingreifen zu können, suchen Forschung und Industrie händeringend nach einer verlässlichen und vor allem frühzeitigen Diagnose für Alzheimer. Ideal wäre ein günstiger Bluttest, der schon geringste Veränderungen des Gehirnstoffwechsels anzeigt, bevor ein Großteil der Nervenzellen unwiederbringlich verloren ist. Jülicher Wissenschaftler haben für ein solches Diagnoseverfahren die Amyloid-beta-Oligomere ins Visier genommen. Es gelang ihnen mit fluoreszierenden Sonden selbst kleinste Mengen der schädlichen Protein-Aggregate in der Rückenmarksflüssigkeit von Alzheimer Patienten aufzuspüren. In ersten Studien gelang es mit überraschender Klarheit die Proben von Alzheimer-Patienten und gesunden Kontrollpersonen zu unterscheiden.
Im Februar 2018 hat sich auf der Basis dieser wissenschaftlichen Erfolge die Firma attyloid GmbH aus dem Forschungszentrum und der Heinrich-Heine-Universität Düsseldorf ausgegründet. Das Verfahren wurde inzwischen vollständig automatisiert und zudem auf den Nachweis anderer Proteinaggregate, wie sie beispielsweise bei Parkinson-Erkrankten vorkommen, erweitert. Das nächste Ziel ist es, ebenfalls aus Blutproben eine verlässliche Frühdiagnose neurodegenerativer Erkrankungen zu gewinnen. Hier sind auch andere Forscherteams aktiv: Ein australisch-japanisches Forscherteam stellte im Februar 2018 einen Bluttest vor, der mit einer Genauigkeit von 90 Prozent erkennt, ob ein Patient frühe Anzeichen der Alzheimer-Erkrankung zeigt. Beide Teams arbeiten mit Hochdruck daran, die Tests zu 100 Prozent zuverlässig zu machen. Denn jedes Puzzleteil hilft, eine frühzeitigere Therapie und mögliche Heilung zu finden.
Brigitte Stahl-Busse
