Hochauflösende Mikroskopie zur Analyse von Proteinkomplexen
16. November 2022 – Forschende des Forschungszentrums Jülich und des Berlin Institute of Health in der Berliner Charité haben eine neuartige Methode entwickelt, mit der sich die Anzahl der Untereinheiten in Proteinkomplexen bestimmen lässt. Bei dem Verfahren handelt es sich um eine Weiterentwicklung der „superauflösenden“ Einzelmolekül-Lokalisationsmikroskopie („single molecule localization microscopy“, SMLM), deren Entwicklung 2014 mit dem Nobelpreis für Chemie ausgezeichnet wurde. Die neue Technik erlaubt es nun, die Zusammensetzung von Proteinkomplexen in intakten Zellen zu analysieren.
Wissenschaftliches Ergebnis
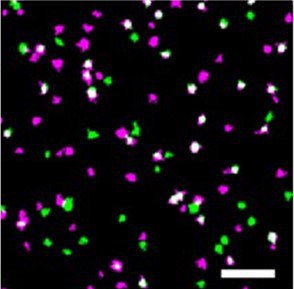
Das neue Verfahren basiert auf der klassischen SMLM, es werden hier allerdings Proteine nicht nur mit einem, sondern mit zwei verschiedenen fluoreszierenden Proteinen markiert. Aus dieser Besonderheit ergibt sich der Name DCC („dual-color colocalization“)-SMLM. Aus dem Grad der Überlappung („colocalization“) beider Farbsignale lässt sich anschließend die mittlere Anzahl von Untereinheiten pro Proteinkomplex errechnen.
Gesellschaftliche und wissenschaftliche Relevanz
Proteine sind die Grundbausteine des Lebens. Sie sind verantwortlich für den Aufbau und die Funktion der Zellen und sind bei allen Aufgaben des Organismus beteiligt. Viele Proteine funktionieren jedoch nicht alleine, sondern nur als Untereinheit größerer Proteinkomplexe. Die Kenntnis, aus wie vielen Untereinheiten ein solcher Proteinkomplex besteht, ist wichtig, um krankheitsverursachende Fehlfunktionen zu verstehen. So gibt es eine Reihe von genetischen Erkrankungen, in denen der Aufbau von Proteinkomplexen gestört sein kann, zum Beispiel bei Defekten im Aufbau von Ionenkanälen bei Herzarrhythmien, Epilepsien oder Nierenfunktionsstörungen.
Weitere Details
Die Anwendung des klassischen SMLM-Verfahrens ist unter anderem dadurch limitiert, dass die Erkennung der notwendigen fluoreszierenden Marker sehr empfindlich auf Störungen reagiert. Hintergrundsignale, welche innerhalb von intakten biologischen Proben unvermeidbar sind, müssen isoliert werden, was in intakten Zellen oft schwierig ist.
Die neue DCC-SMLM-Technik verhält sich deutlich unempfindlicher gegenüber solchen Störsignalen und ermöglicht eine genaue Zählung auch beim Einsatz von wenig effizienten Fluoreszenzmarkern. Damit ermöglicht es die DCC-SMLM, Proteinkomplexe in der Zellmembran intakter Zellen zu untersuchen.
In ihrer Arbeit konnten die Forschenden so die Zusammensetzung von Komplexen, die für den Transport des Botenstoffs Glutamat in Nervenzellen verantwortlich sind, aufklären. Die Wissenschaftler:innen konnten zudem zeigen, dass Proteinkomplexe der sogenannten SLC26-Familie auch in intakten Zellen aus zwei Untereinheiten bestehen. Diese kommen unter anderem im Darm, in der Niere und in Haarzellen im Innenohr vor, wo sie als Motorproteine für die besondere Empfindlichkeit unseres Hörsinnes verantwortlich sind. Bisherige Untersuchungen waren widersprüchlich und hatten in intakten Zellen 4 Untereinheiten, in aufgereinigten Proteinen jedoch nur 2 Untereinheiten pro Komplex vorhergesagt.
Originalpublikation
Determination of oligomeric states of proteins via dual-color colocalization with single molecule localization microscopy
Hua Leonhard Tan, Stefanie Bungert-Plümke, Daniel Kortzak, Christoph Fahlke, Gabriel Stölting
eLife (7 October 2022), DOI: 10.7554/eLife.76631
Ansprechpartner


