Erstmals "Funktionsverlust" des Alzheimer-Proteins Aβ beobachtet
Durch Aggregation verliert Aβ die Bindefähigkeit an einen wichtigen Bestandteil der Nervenzellmembran
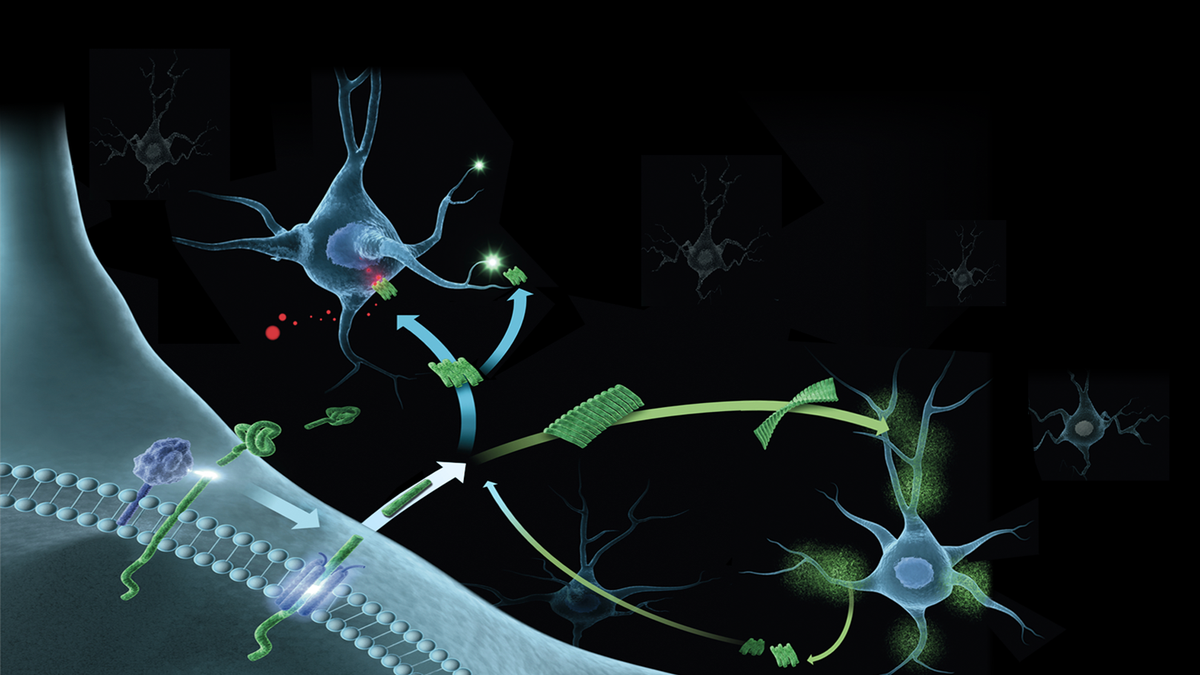
Jülich / Düsseldorf, 16.12.2016 - Die Verklumpung des Proteins Amyloid-beta (Aβ) im Gehirn gilt als entscheidender Auslöser der Alzheimerschen Demenz. Die entstehenden Aggregate erhalten gegenüber dem Aβ-Einzelmolekül, dem sogenannten "Monomer", dabei neue, toxische Eigenschaften. Eine Studie von Wissenschaftlern des Forschungszentrums Jülich und der Heinrich-Heine-Universität (HHU) Düsseldorf liefert nun das erste Beispiel für eine "normale" Funktion von A?-Monomeren, die bei der Aggregation verloren geht. Sie stellten fest, dass Aβ in der aggregierten Form seine Fähigkeit verliert, an das GM1-Gangliosid zu binden, einen Bestandteil von Nervenzellmembranen, der in viele neuronale Prozesse involviert ist. Das Ergebnis wirft die Frage auf, ob im Krankheitsverlauf neben toxischen Wirkungen der Aggregate auch der Verlust einer möglichen physiologischen Funktion des Aβ-Einzelproteins eine Rolle spielt. Die Studie wurde in der Fachzeitschrift "Biochemistry" veröffentlicht.
Amyloid-beta ist ein kleines Eiweiß, das bei jedem Menschen das ganze Leben lang gebildet wird und zunächst harmlos ist. Erst wenn die Einzelmoleküle miteinander zu sogenannten Aβ-Oligomeren aggregieren, entfaltet sich seine neurotoxische Wirkung. Die molekulare Wechselwirkung des Proteins und seiner Aggregate mit der Nervenzellmembran scheint dabei eine wichtige Rolle spielen. Doch noch ist über diese Vorgänge wenig bekannt, ebenso wie über die normale physiologische Funktion des Proteins.
Experimente von Forschern des Jülicher Institute of Complex Systems

Dass die Aβ-Monomere im Versuch eine hochaffine, also sehr feste, Bindung mit GM1 eingingen, ist zum einen für das Verständnis der Proteinverklumpung interessant: Das so gebundene Aβ kann nicht mehr aggregieren, was Beobachtungen eines hemmenden Effektes von GM1 auf die Proteinverklumpungen erklären könnte. "Man weiß zudem, dass die GM1-Konzentration im Alter absinkt", sagt ICS-6-Direktor Prof. Dieter Willbold.
Darüber hinaus könnte die Bindung an GM1 auf eine noch unbekannte Funktion des A?-Monomers im Gehirn hinweisen. GM1 wird unter anderem mit verschiedenen zellulären Signalwegen in Verbindung gebracht und ist ein Wachstumsfaktor für die Ausbildung neuer Nervenfortsätze. Wenn das Protein durch die Aggregation seine Bindefähigkeit an GM1 verliert, könnte dieser Funktionsverlust als zusätzlicher Faktor zur neu entstehenden toxischen Wirkung der A?-Aggregate hinzukommen. Die Überprüfung dieser neuen Spur wäre aber nur in weiterführenden zellbiologischen Experimenten möglich, so die Forscher.

Originalpublikation:
Maren Thomaier, Lothar Gremer, Christina Dammers, Judith Fabig, Philipp Neudecker, Dieter Willbold: High-Affinity Binding of Monomeric but Not Oligomeric Amyloid-β to Ganglioside GM1 Containing Nanodiscs Biochemistry, 2016, 55 (48), pp 6662–6672
Weitere Informationen
Institut of Complex Systems, Strukturbiochemie (ICS-6)
Neben experimentellen Zugängen wird die Aβ -Membran-Interaktion am Institut auch in aufwändigen Simulationen auf Supercomputern erforscht.
Meldung (24. 05. 2016): Geballte Rechenpower für Jülicher Alzheimer-Forschung
Ansprechpartner:
Dr. Lothar Gremer
Institute of Complex Systems, Strukturbiochemie (ICS-6), Forschungszentrum Jülich
Institut für Physikalische Biologie der Heinrich-Heine-Universität Düsseldorf
Telefon: +49 211 81-13095
E-Mail:
l.gremer@fz-juelich.de
Prof. Dieter Willbold
Institute of Complex Systems, Strukturbiochemie (ICS-6), Forschungszentrum Jülich
Institut für Physikalische Biologie der Heinrich-Heine-Universität Düsseldorf
Tel. +49 2461 61-2100
E-Mail:
d.willbold@fz-juelich.de
Pressekontakt:
Peter Zekert
Tel: +49 2461 61-9711
E-Mail:
p.zekert@fz-juelich.de
