Wie Zellen Ordnung halten
Jülich, 23.01.2020. Ausmisten liegt im Trend und soll sogar – verspricht ein Sachbuch-Bestseller – Leben verändern können. Lebenswichtig ist regelmäßiges Ausmisten ohne Zweifel für Zellen: Proteine und Zellorganellen, die zu alt geworden sind und nicht mehr richtig funktionieren, müssen rechtzeitig weichen für neue. Ist dieser Prozess gestört, können Zellen geschädigt werden und neurodegenerative Krankheiten entstehen. Neue Erkenntnisse zum zellulären Reinigungs-Mechanismus hat nun ein Team von Forschern aus Deutschland und Norwegen veröffentlicht.
Zellen entledigen sich ihres Abfalls in einem zweistufigen Prozess namens Autophagie. Dabei werden Zelltrümmer zunächst in blasenartigen Vesikeln gesammelt, die als Autophagosomen bezeichnet werden. Als nächstes werden diese Autophagosomen an Lysosomen, membrangebundene Säcke, abgegeben, in denen spezialisierte Enzyme den Zellmüll aufgespalten.
Obwohl die Grundzüge dieses Prozesses bekannt sind, sind Einzelheiten seines Ablaufs bisher unklar geblieben. Die neuen Untersuchungen der Forscher aus Jülich, Heidelberg, Hamburg und Norwegen konzentrierten sich auf die Rolle eines Proteins namens p62, das eine wichtige Rolle bei der Autophagie spielt, indem es Zellmüll an Autophagosomen abgibt.
Frühere Studien haben gezeigt, dass p62 aus drei Domänen mit jeweils unterschiedlicher Rolle besteht. Die PB1-Domäne ermöglicht es einzelnen p62-Proteinen, sich miteinander zu verbinden, um lange Ketten zu bilden. Eine andere, die UBA-Domäne, erkennt spezielle Protein-Tags, die als Polyubiquitin bezeichnet werden und an Proteinen und Organellen haften, die entfernt werden müssen. Die dritte Domäne, LIR, ermöglicht die Bindung von p62 an Autophagosomen, wodurch sichergestellt wird, dass jede an UBA gebundene Ladung im Autophagosom landet.
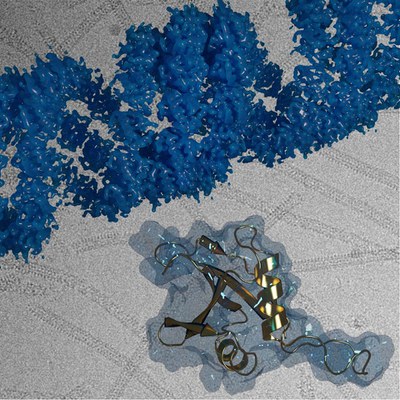
Prof. Dr. Carsten Sachse, Direktor am Jülicher Ernst Ruska-Centrum für Mikroskopie und Spektroskopie mit Elektronen, und seine Kollegen wiesen nun nach, dass die Polymerisierung der p62-Proteine zu Ketten essentiell für den Proteinabbau über Autophagie ist. Sie zeigten, dass schon kleinere Polymerketten ausreichen, um Autophagosomen und Lysosomen zusammen zu bringen, nicht aber Einzelproteine. Die Forscher bildeten zudem mit Hilfe der Kryo-Elektronenmikroskopie die gewundene Gerüststruktur der Ketten erstmals mit atomarer Auflösung ab. Die Technik eignet sich gut, um die Struktur großer Proteine aufzuklären, ohne diese durch Präparationsmaßnahmen, die für andere Methoden nötig sind, womöglich zu verändern. Die Untersuchungen verschiedener p62-Untertypen aus Ackerschmalwand (Arabidopsis thaliana), auch als Gänserauke bekannt, sowie menschlichen Zellen legen zudem nahe, dass der Prozess in pflanzlichen und tierischen Zellen gleich abläuft.
Originalveröffentlichung:
Structural basis of p62/SQSTM1 helical filaments and their role in cellular cargo uptake.
Nat Commun 11, 440 (2020). DOI:
10.1038/s41467-020-14343-8
Weitere Informationen:
Website des Ernst Ruska-Centrum für Mikroskopie und Spektroskopie mit Elektronen – Strukturbiologie (ER-C-3)
Website des Sachse Lab
Kontakt:
Prof. Dr. Carsten Sachse
Ernst Ruska-Centrum für Mikroskopie und Spektroskopie mit Elektronen – Strukturbiologie (ER-C-3)
Tel: 02461 61-2030
E-Mail:
c.sachse@fz-juelich.de
Pressekontakt:
Angela Wenzik, Wissenschaftsjournalistin
Forschungszentrum Jülich
Tel: 02461 61-6048
E-Mail:
a.wenzik@fz-juelich.de
