Patricia Hidalgo
Prof. Dr. Patricia Hidalgo filmt die Reise von Calcium-Ionenkanälen durch das Zellinnere.
27. November 2025
Wenn drei kluge Köpfe aus unterschiedlichen Disziplinen zusammenkommen, kann etwas ganz Besonderes entstehen. Genau das ist Prof. Dr. Patricia Hidalgo, Dr. Beatrix Santiago-Schübel und Dr. Mercedes Alfonso-Prieto am Forschungszentrum Jülich gelungen. In einem interdisziplinären Projekt untersuchten sie, wie Zellen fehlerhafte Calciumkanäle erkennen und beseitigen – eine Arbeit, die nicht nur für die Grundlagenforschung von Bedeutung ist, sondern auch neue Ansätze für künftige Therapien für neurodegenerative Erkrankungen eröffnen könnte.

Ihr Projekt zeigt eindrucksvoll, wie wertvoll enge, interdisziplinäre Zusammenarbeit über Institutsgrenzen hinweg ist – und wie vielfältige Teams von den unterschiedlichen Perspektiven und Erfahrungswerten profitieren. Im Interview berichten sie über ihre Forschung und die Zusammenarbeit in diesem Projekt.
Für alle, die nicht täglich mit Zellbiologie zu tun haben: Was genau sind spannungsgesteuerte Calciumkanäle – und warum sind sie so wichtig?
Calciumkanäle sind winzige „Tore“ in der Zellmembran, die sich nur öffnen, wenn sich die elektrische Spannung an der Membran verändert. Dann strömen Calcium-Ionen in die Zelle – ein Startsignal, das eine Reihe lebenswichtiger Prozesse auslöst, etwa das Denken, das Erinnern oder auch die Bewegung von Muskeln. Damit sind Calciumkanäle ein zentraler Baustein dafür, wie Zellen im Gehirn und im Herzen Informationen verarbeiten.
Was haben Sie in Ihrer gemeinsamen Studie über die Calciumkanäle herausgefunden und welche Bedeutung hat es für dieses Forschungsgebiet?
Wir wollten verstehen, wie Zellen die Lebensdauer von spannungsgesteuerten Calciumkanälen regulieren. Diese Lebensdauer ist entscheidend. Werden die Kanäle zu früh abgebaut oder bleiben sie zu lange aktiv, gerät das empfindliche Gleichgewicht des Systems aus dem Lot und die Kommunikation im Nervensystem oder auch der Herzschlag funktioniert nicht mehr korrekt.
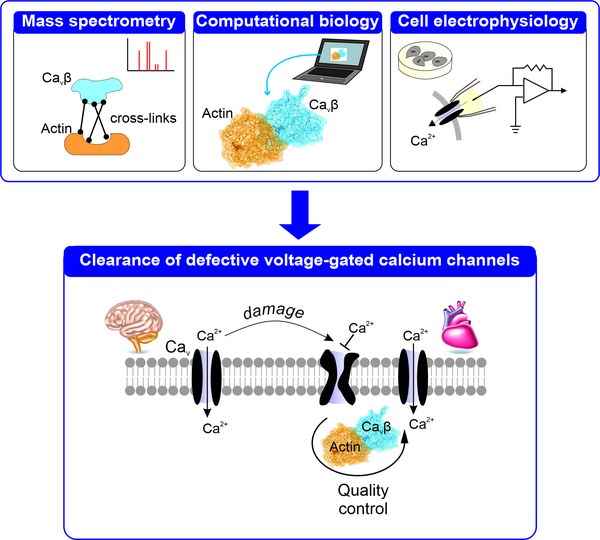
Damit Zellen dauerhaft funktionsfähig bleiben, verfügen sie über eine Art zelluläre Qualitätskontrolle, ein System, das fehlerhafte Proteine erkennt, markiert, entfernt und die Stabilität und Funktionalität erhält. Wir wussten bereits, dass CaVβ, eine Untereinheit dieser Calciumkanäle, mit Aktin interagiert – ein Strukturprotein, das der Zelle ihre Form gibt und den inneren Transport organisiert.
Nun konnten wir zeigen, dass diese Verbindung entscheidend ist: Wird sie geschwächt, bleibt zwar die Zahl der Kanäle an der Zelloberfläche unverändert, aber fehlerhafte Kanäle werden nicht entfernt und durch funktionstüchtige ersetzt. Die Interaktion zwischen CaVβ und Aktin unterstützt die Zelle also dabei, defekte Kanäle zu erkennen und funktionsfähige Kanäle zu erhalten.
Diese Erkenntnis ist nicht nur für die Grundlagenforschung spannend, sondern könnte langfristig auch medizinisch relevant werden. Die neu beschriebene Schnittstelle zwischen CaVβ und Aktin könnte ein Ansatzpunkt sein, um gezielt in die zelleigene Qualitätskontrolle einzugreifen – etwa bei neurodegenerativen Erkrankungen oder altersbedingtem Funktionsverlust, bei denen fehlerhafte Proteine eine Rolle spielen.
Was war der erste Schritt im Projekt?
Die Grundlagen für diese Arbeit hat Patricia am Institut für Biologische Informationsprozesse – Molekular- und Zellphysiologie gelegt, wo sie die Interaktion zwischen CaVβ und Aktin nachweisen konnte. Mithilfe von sogenannten Patch-Clamp-Experimenten, mit denen der Ionenfluss durch einzelne Kanäle in der Zellmembran gemessen wird, konnten wir Folgendes beobachten: wird diese Verbindung von CaVβ und Aktin gezielt blockiert, verringern sich die Calciumströme. Der nächste logische Schritt war, die genaue Kontaktfläche zwischen den beiden Proteinen zu ermitteln.
Und wie sind Sie dabei vorgegangen?
Patricia suchte gezielt nach Partnern am Forschungszentrum, die ihr dabei helfen konnten, die genaue Kontaktfläche der Proteine zu identifizieren. Beatrix arbeitet am gleichen Institut, aber im Bereich Strukturbiochemie und kombinierte chemische Vernetzung mit Tandem-Massenspektrometrie, eine Methode, die präzise zeigt, an welchen Stellen Proteine miteinander verbunden sind. So gelang es uns, den ersten vernetzten CaVβ/Aktin-Komplex herzustellen und eine detaillierte massenspektrometrische Analyse durchzuführen
Nun benötigten wir jemanden, der diese Daten in molekulare Abstände übersetzen konnte. Genau das ist das Spezialgebiet von Mercedes vom Institut für Neurowissenschaften und Medizin – Computational Biomedicine. Die ersten Ergebnisse waren vielversprechend und motivierten sie, sich sofort dem Projekt anzuschließen. Gemeinsam haben wir uns dann um Förderung im FZJ-Programm „Vernetzungsdoktoranden“ beworben – mit Erfolg! So kam unser Doktorand Francisco Castilla aus Spanien ins Spiel, der in der Hochphase der Covid-Pandemie mit großem Enthusiasmus und Energie an unserem gemeinsamen Projekt gearbeitet hat. Er ermutigte zudem Victor Lugo, seinen Doktoranden-Kollegen, die elektrophysiologischen Experimente durchzuführen. Über mehrere Jahre hinweg hatten wir einen intensiven, interdisziplinären Austausch zwischen drei Instituten – und am Ende den wissenschaftlichen Erfolg, den wir uns erhofft hatten.
Was hat dieses Projekt Ihrer Meinung nach so erfolgreich gemacht?
Unser Projekt war so erfolgreich, weil wir unsere unterschiedlichen Fachrichtungen – Elektrophysiologie, Massenspektrometrie und computergestützte Modellierung zusammengebracht haben. Dieser interdisziplinäre Ansatz ermöglichte uns das Problem aus verschiedenen Blickwinkeln anzugehen.
Gleichzeitig ist unsere Zusammenarbeit ein gutes Beispiel für das Potenzial, das Vielfalt in der Forschung freisetzen kann. Außerdem sind wir auf dem Weg zu unserem Ziel nicht nur Kolleginnen, sondern auch Freundinnen geworden.
Castilla, F., Lugo, V., Miranda-Laferte, E., Jordan, N., Huesgen, P. F., Santiago-Schübel, B., Alfonso-Prieto, M., & Hidalgo, P. (2025). Mapping the interaction surface between CaVβ and actin and its role in calcium channel clearance. Nature Communications, 16(1), 4352. https://doi.org/10.1038/s41467-025-59548-x